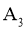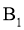2021年广东高考化学真题
2021年广东省普通高中学业水平选择性考试
化学
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Fe 56
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 今年五一假期,人文考古游持续成为热点。很多珍贵文物都记载着中华文明的灿烂成就,具有深邃的文化寓意和极高的学术价值。下列国宝级文物主要由合金材料制成的是( )
选项 | A | B | C | D |
文物 |
|
|
|
|
名称 | 铸客大铜鼎 | 河姆渡出土陶灶 | 兽首玛瑙杯 | 角形玉杯 |
2. 广东有众多国家级非物质文化遗产,如广东剪纸、粤绣、潮汕工夫茶艺和香云纱染整技艺等。下列说法不正确的是( )
A. 广东剪纸的裁剪过程不涉及化学变化
B. 冲泡工夫茶时茶香四溢,体现了分子是运动的
C. 制作粤绣所用的植物纤维布含有天然高分子化合物
D. 染整技艺中去除丝胶所用的纯碱水溶液属于纯净物
3. “天问一号”着陆火星,“嫦娥五号”采回月壤。腾飞中国离不开化学,长征系列运载火箭使用的燃料有液氢和煤油等化学品。下列有关说法正确的是( )
A. 煤油是可再生能源
B. 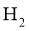 燃烧过程中热能转化为化学能
燃烧过程中热能转化为化学能
C. 火星陨石中的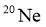 质量数为20
质量数为20
D. 月壤中的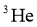 与地球上的
与地球上的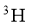 互为同位素
互为同位素
4. 化学创造美好生活。下列生产活动中,没有运用相应化学原理的是( )
选项 | 生产活动 | 化学原理 |
A | 用聚乙烯塑料制作食品保鲜膜 | 聚乙烯燃烧生成 |
B | 利用海水制取溴和镁单质 |
|
C | 利用刻蚀石英制作艺术品 | 可与 |
D | 公园的钢铁护栏涂刷多彩防锈漆 | 钢铁与潮湿空气隔绝可防止腐蚀 |
5. 昆虫信息素是昆虫之间传递信号的化学物质。人工合成信息素可用于诱捕害虫、测报虫情等。一种信息素的分子结构简式如图1所示,关于该化合物说法不正确的是( )
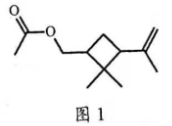
A. 属于烷烃
B. 可发生水解反应
C. 可发生加聚反应
D. 具有一定的挥发性
6. 劳动成就梦想。下列劳动项目与所述的化学知识没有关联的是( )
选项 | 劳动项目 | 化学知识 |
A | 社区服务:用84消毒液对图书馆桌椅消毒 | 含氯消毒剂具有氧化性 |
B | 学农活动:用厨余垃圾制肥料 | 厨余垃圾含 |
C | 家务劳动:用白醋清洗水壶中的水垢 | 乙酸可由乙醇氧化制备 |
D | 自主探究:以油脂为原料制肥皂 | 油脂可发生皂化反应 |
7. 测定浓硫酸试剂中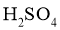 含量的主要操作包括:①量取一定量的浓硫酸,稀释;②转移定容得待测液;③移取
含量的主要操作包括:①量取一定量的浓硫酸,稀释;②转移定容得待测液;③移取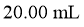 待测液,用
待测液,用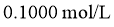 的
的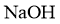 溶液滴定。上述操作中,不需要用到的仪器为( )
溶液滴定。上述操作中,不需要用到的仪器为( )
A. 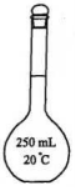 B.
B.  C.
C.  D.
D. 
8. 鸟嘌呤(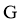 )是一种有机弱碱,可与盐酸反应生成盐酸盐(用
)是一种有机弱碱,可与盐酸反应生成盐酸盐(用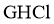 表示)。已知
表示)。已知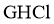 水溶液呈酸性,下列叙述正确的是( )
水溶液呈酸性,下列叙述正确的是( )
A. 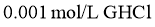 水溶液的
水溶液的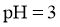
B. 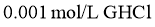 水溶液加水稀释,
水溶液加水稀释,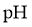 升高
升高
C. 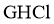 在水中的电离方程式为:
在水中的电离方程式为: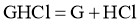
D. 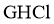 水溶液中:
水溶液中: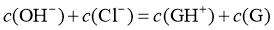
9. 火星大气中含有大量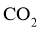 ,一种有
,一种有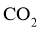 参加反应的新型全固态电池有望为火星探测器供电。该电池以金属钠为负极,碳纳米管为正极,放电时( )
参加反应的新型全固态电池有望为火星探测器供电。该电池以金属钠为负极,碳纳米管为正极,放电时( )
A. 负极上发生还原反应 B. 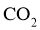 在正极上得电子
在正极上得电子
C. 阳离子由正极移向负极 D. 将电能转化为化学能
10. 部分含铁物质的分类与相应化合价关系如图2所示。下列推断不合理的是( )
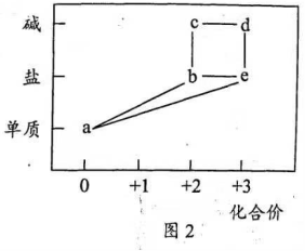
A. 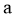 可与
可与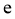 反应生成
反应生成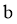
B. 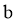 既可被氧化,也可被还原
既可被氧化,也可被还原
C. 可将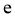 加入浓碱液中制得
加入浓碱液中制得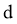 的胶体
的胶体
D. 可存在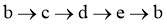 的循环转化关系
的循环转化关系
11. 设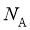 为阿伏加德罗常数的值。下列说法正确的是( )
为阿伏加德罗常数的值。下列说法正确的是( )
A.  含有
含有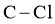 键的数目为
键的数目为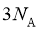
B. 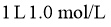 的盐酸含有阴离子总数为
的盐酸含有阴离子总数为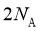
C.  与
与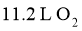 混合后的分子数目为
混合后的分子数目为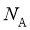
D. 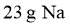 与足量
与足量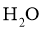 反应生成的
反应生成的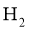 分子数目为
分子数目为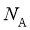
12. 化学是以实验为基础的科学。下列实验操作或做法正确且能达到目的的是( )
选项 | 操作或做法 | 目的 |
A | 将铜丝插入浓硝酸中 | 制备 |
B | 将密闭烧瓶中的 | 探究温度对平衡移动的影响 |
C | 将溴水滴入 | 萃取溶液中生成的碘 |
D | 实验结束,将剩余 | 节约试剂 |
13. 一种麻醉剂的分子结构式如图3所示。其中,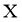 的原子核只有1个质子;元素
的原子核只有1个质子;元素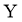 、
、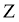 、
、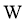 原子序数依次增大,且均位于
原子序数依次增大,且均位于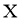 的下一周期;元素
的下一周期;元素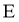 的原子比
的原子比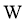 原子多8个电子。下列说法不正确的是( )
原子多8个电子。下列说法不正确的是( )
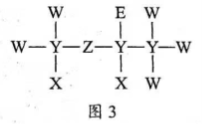
A. 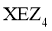 是一种强酸
是一种强酸
B. 非金属性:
C. 原子半径: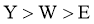
D. 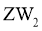 中,
中,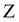 的化合价为+2价
的化合价为+2价
14. 反应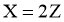 经历两步:①
经历两步:①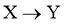 ;②
;②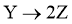 。反应体系中
。反应体系中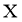 、
、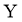 、
、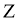 的浓度
的浓度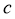 随时间
随时间 的变化曲线如图4所示。下列说法不正确的是( )
的变化曲线如图4所示。下列说法不正确的是( )
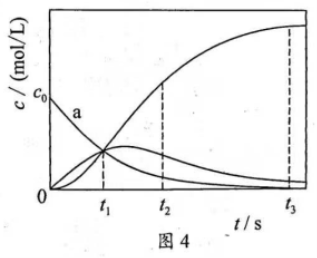
A.  为
为 随
随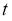 的变化曲线
的变化曲线
B. 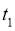 时,
时,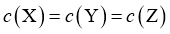
C.  时,
时,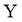 的消耗速率大于生成速率
的消耗速率大于生成速率
D. 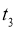 后,
后,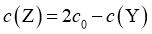
15. 宏观辨识与微观探析是化学学科核心素养之一。下列物质性质实验对应的反应方程式书写正确的是( )
A. 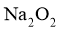 放入水中:
放入水中:
B.  通过灼热铁粉:
通过灼热铁粉: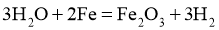
C. 钢丝插入热的浓硫酸中:
D. 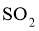 通入酸性
通入酸性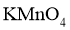 溶液中:
溶液中: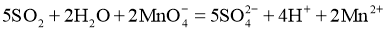
16. 钴( )的合金材料广泛应用于航空航天、机械制造等领域。图5为水溶液中电解制备金属钴的装置示意图。下列说法正确的是( )
)的合金材料广泛应用于航空航天、机械制造等领域。图5为水溶液中电解制备金属钴的装置示意图。下列说法正确的是( )
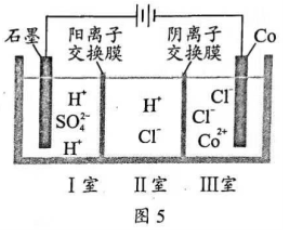
A. 工作时,Ⅰ室和Ⅱ室溶液的 均增大
均增大
B. 生成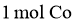 ,Ⅰ室溶液质量理论上减少
,Ⅰ室溶液质量理论上减少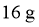
C. 移除两交换膜后,石墨电极上发生的反应不变
D. 电解总反应: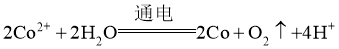
二、非选择题:共56分。第17~19题为必考题,考生都必须作答。第20~21题为选考题,考生根据要求作答。
(一)必考题:共42分。
17.(15分)
含氯物质在生产生活中有重要作用。1774年,舍勒在研究软锰矿(主要成分是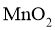 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“”)。
)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为chlorine(中文命名“”)。
(1)实验室沿用舍勒的方法制取 的化学方程式为___________。
的化学方程式为___________。
(2)实验室制取干燥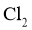 时,净化与收集
时,净化与收集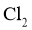 所需装置的接口连接顺序为___________。
所需装置的接口连接顺序为___________。

(3)某氯水久置后不能使品红溶液褪色,可推测氯水中__________已分解。检验此久置氯水中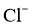 存在的操作及现象是___________。
存在的操作及现象是___________。
(4)某合作学习小组进行以下实验探究。
①实验任务 通过测定溶液电导率,探究温度对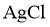 溶解度的影响。
溶解度的影响。
②查阅资料 电导率是表征电解质溶液导电能力的物理量。温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大;离子浓度一定时,稀溶液电导率随温度的升高而增大。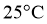 时,
时,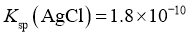 。
。
③提出猜想 猜想a:较高温度的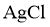 饱和溶液的电导率较大。
饱和溶液的电导率较大。
猜想b: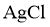 在水中的溶解度
在水中的溶解度 。
。
④设计实验、验证猜想 取试样Ⅰ、Ⅱ、Ⅲ(不同温度下配制的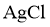 饱和溶液),在设定的测试温度下,进行表1中实验1~3,记录数据。
饱和溶液),在设定的测试温度下,进行表1中实验1~3,记录数据。
表1
实验序号 | 试样 | 测试温度/ | 电导率/ |
1 | Ⅰ: | 25 |
|
2 | Ⅱ: | 35 |
|
3 | Ⅲ: | 45 |
|
⑤数据分析、交流讨论 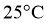 的
的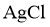 饱和溶液中,
饱和溶液中,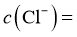 __________
__________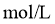 。
。
实验结果为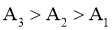 。小组同学认为,此结果可以证明③中的猜想
。小组同学认为,此结果可以证明③中的猜想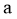 成立,但不足以证明猜想
成立,但不足以证明猜想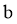 成立。结合②中信息,猜想
成立。结合②中信息,猜想 不足以成立的理由有_______________。
不足以成立的理由有_______________。
⑥优化实验 小组同学为进一步验证猜想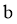 ,在实验1~3的基础上完善方案,进行实验4和5。请在答题卡上完成表2中内容。
,在实验1~3的基础上完善方案,进行实验4和5。请在答题卡上完成表2中内容。
表2
实验序号 | 试样 | 测试温度/ | 电导率/ |
4 | Ⅰ | __________ |
|
5 | __________ | __________ |
|
⑦实验总结 根据实验1~5的结果,并结合②中信息,小组同学认为猜想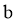 也成立。猜想
也成立。猜想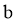 成立的判断依据是____________。
成立的判断依据是____________。
18.(13分)
对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝(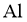 )、钼(
)、钼(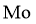 )、镍(
)、镍(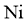 )等元素的氧化物,一种回收利用工艺的部分流程如下:
)等元素的氧化物,一种回收利用工艺的部分流程如下:
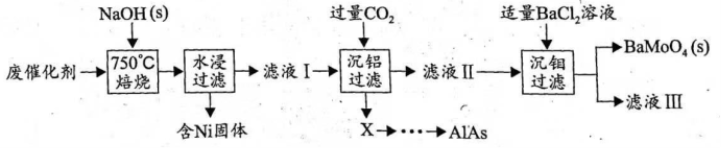
已知: 时,
时,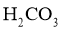 的
的 ,
,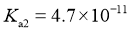 ;
;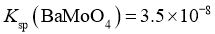 ;
;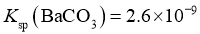 ;该工艺中,
;该工艺中,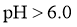 时,溶液中
时,溶液中 元素以
元素以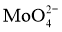 的形态存在。
的形态存在。
(1)“焙烧”中,有 生成,其中
生成,其中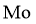 元素的化合价为____________。
元素的化合价为____________。
(2)“沉铝”中,生成的沉淀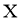 为______________。
为______________。
(3)“沉钼”中, 为7.0。
为7.0。
①生成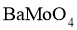 的离子方程式为__________。
的离子方程式为__________。
②若条件控制不当,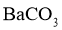 也会沉淀。为避免
也会沉淀。为避免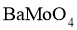 中混入
中混入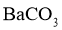 沉淀,溶液中
沉淀,溶液中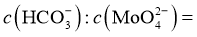 ___________(列出算式)时,应停止加入
___________(列出算式)时,应停止加入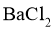 溶液。
溶液。
(4)①滤液Ⅲ中,主要存在的钠盐有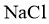 和
和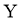 ,
,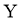 为___________。
为___________。
②往滤液Ⅲ中添加适量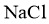 固体后,通入足量______________(填化学式)气体,再通入足量
固体后,通入足量______________(填化学式)气体,再通入足量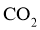 ,可析出
,可析出 。
。
(5)高纯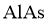 (砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图6所示,图中所示致密保护膜为一种氧化物,可阻止
(砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图6所示,图中所示致密保护膜为一种氧化物,可阻止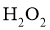 刻蚀液与下层
刻蚀液与下层 (砷化镓)反应。
(砷化镓)反应。
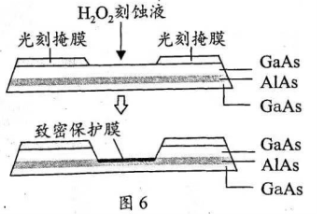
①该氧化物为___________。
②已知: 和
和 同族,
同族,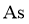 和
和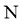 同族。在
同族。在 与上层
与上层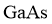 的反应中,
的反应中, 元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为___________。
元素的化合价变为+5价,则该反应的氧化剂与还原剂物质的量之比为___________。
19.(14分)
我国力争于2030年前做到碳达峰,2060年前实现碳中和。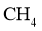 与
与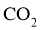 重整是
重整是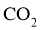 利用的研究热点之一。该重整反应体系主要涉及以下反应:
利用的研究热点之一。该重整反应体系主要涉及以下反应:
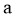 )
)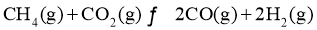
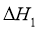
 )
)

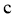 )
)
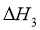
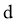 )
)
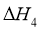
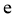 )
)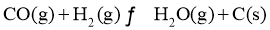
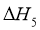
(1)根据盖斯定律,反应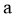 的
的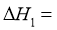 ______________(写出一个代数式即可)。
______________(写出一个代数式即可)。
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有__________。
A. 增大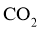 与
与 的浓度,反应
的浓度,反应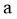 、
、 、
、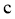 的正反应速率都增加
的正反应速率都增加
B. 移去部分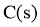 ,反应
,反应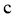 、
、 、
、 的平衡均向右移动
的平衡均向右移动
C. 加入反应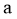 的催化剂,可提高
的催化剂,可提高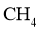 的平衡转化率
的平衡转化率
D. 降低反应温度,反应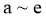 的正、逆反应速率都减小
的正、逆反应速率都减小
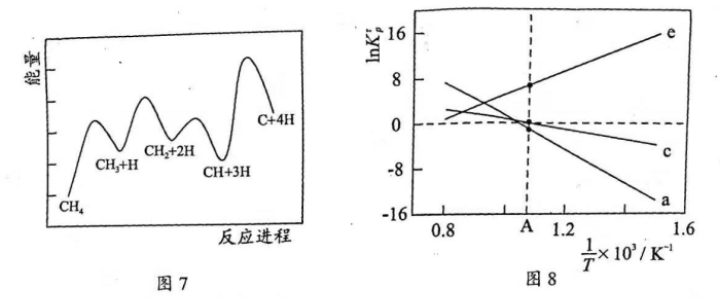
(3)一定条件下,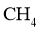 分解形成碳的反应历程如图7所示。该历程分_________步进行,其中,第________步的正反应活化能最大。
分解形成碳的反应历程如图7所示。该历程分_________步进行,其中,第________步的正反应活化能最大。
(4)设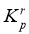 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为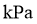 )除以
)除以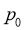 (
(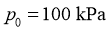 )。反应
)。反应 、
、 、
、 的
的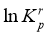 随
随 (温度的倒数)的变化如图8所示。
(温度的倒数)的变化如图8所示。
①反应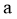 、
、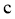 、
、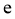 中,属于吸热反应的有__________(填字母)。
中,属于吸热反应的有__________(填字母)。
②反应 的相对压力平衡常数表达式为
的相对压力平衡常数表达式为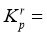 __________。
__________。
③在图8中 点对应温度下、原料组成为
点对应温度下、原料组成为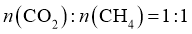 、初始总压为
、初始总压为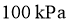 的恒容密闭容器中进行反应,体系达到平衡时
的恒容密闭容器中进行反应,体系达到平衡时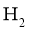 的分压为
的分压为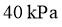 。计算
。计算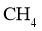 的平衡转化率,写出计算过程。
的平衡转化率,写出计算过程。
(5)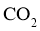 用途广泛,写出基于其物理性质的一种用途:____________________。
用途广泛,写出基于其物理性质的一种用途:____________________。
(二)选考题:共14分。请考生从2道题中任选一题作答。如果多做,则按所做的第一题
计分。
- [选修3:物质结构与性质](14分)
很多含巯基(-SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物I可与生成化合物Ⅱ。
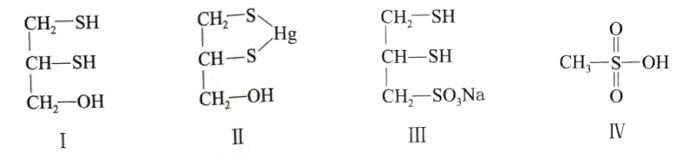
(1)基态硫原子价电子排布式为 。
(2)H2S、CH4、H2O的沸点由高到低顺序为 。
(3)汞的原子序数为80,位于元素周期表第 周期第ⅡB族。
(4)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有 。
A. 在I中S原子采取sp3杂化 B. 在Ⅱ中S元素的电负性最大
C. 在Ⅲ中C-C-C键角是180° D. 在Ⅲ中存在离子键与共价键
E. 在Ⅳ中硫氧键的键能均相等
(5)汞解毒剂的水溶性好,有利于体内 重金属元素汞的解毒。化合物I与化合物Ⅲ相比,水溶性较好的是 。
(6)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑
绝缘体材料。X的晶体可视为Ge晶体(晶胞如图9a所示)中部分Ge原子被Hg和Sb
取代后形成。
①图9b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶
胞单元,理由是 。
②图9c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为 ;该晶胞中
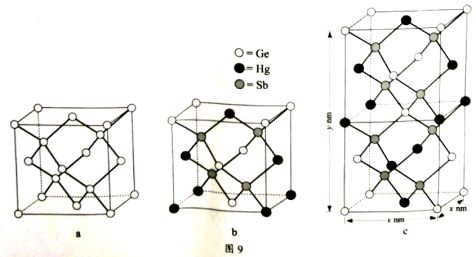 粒子个数比Hg:Ge:Sb = 。
粒子个数比Hg:Ge:Sb = 。
③设X的最简式的式量为Mr,则X
晶体的密度为 g/cm3(列出
算式)。
21. [选修5:有机化学基础](14分)
天然产物Ⅴ具有抗疟活性,某研究小组以化合物Ⅰ为原料合成Ⅴ及其衍生物Ⅵ的路线如下(部分反应条件省略, 表示
表示 ):
):
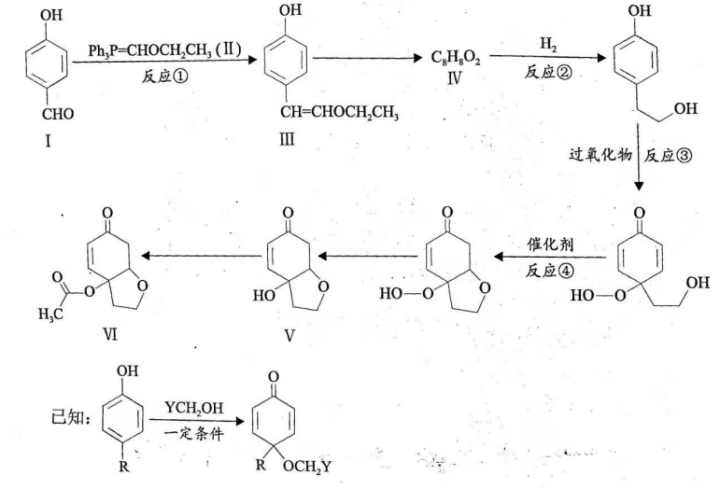
(1)化合物Ⅰ中含氧官能团有____________(写名称)。
(2)反应①的方程式可表示为: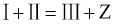 ,化合物
,化合物 的分子式为__________。
的分子式为__________。
(3)化合物Ⅳ能发生银镜反应,其结构简式为__________。
(4)反应②③④中属于还原反应的有___________,属于加成反应的有___________。
(5)化合物Ⅵ的芳香族同分异构体中,同时满足如下条件的有___________种,写出其中任意一种的结构简式:__________。
条件: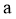 )能与
)能与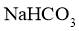 反应;
反应;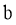 )最多能与2倍物质的量的
)最多能与2倍物质的量的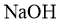 反应;
反应;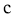 )能与3倍物质的量的
)能与3倍物质的量的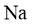 发生放出
发生放出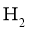 的反应;
的反应; )核磁共振氢谱确定分子中有6个化学环境相同的氢原子;
)核磁共振氢谱确定分子中有6个化学环境相同的氢原子; )不含手性碳原子(手性碳原子是指连有4个不同的原子或原子团的饱和碳原子)。
)不含手性碳原子(手性碳原子是指连有4个不同的原子或原子团的饱和碳原子)。
(6)根据上述信息,写出以苯酚的一种同系物及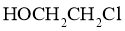 为原料合成
为原料合成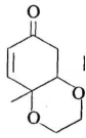 的路线__________(不需注明反应条件)。
的路线__________(不需注明反应条件)。




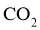 和
和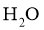
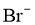 可被氧化、
可被氧化、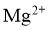 可被还原
可被还原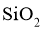 反应
反应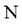 、
、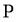 、
、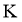 等元素
等元素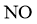
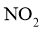 降温
降温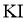 溶液中,加入乙醇并振荡
溶液中,加入乙醇并振荡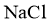 固体放回原试剂瓶
固体放回原试剂瓶
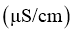
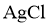 饱和溶液
饱和溶液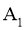
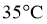 的
的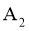
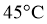 的
的